Rimasti…SHOCKati
Facciamo Progressi!
di Leonardo De Luca
Lo shock cardiogeno nelle sindromi coronariche acute
Nonostante i significativi miglioramenti diagnostici e terapeutici, lo shock cardiogeno (SC) rimane la principale causa di morte nei pazienti ospedalizzati per infarto miocardico acuto (IMA). Sebbene la sua incidenza sia in lieve riduzione – grazie all’aumentata disponibilità di eseguire angioplastica coronarica percutanea (PCI) con precoce ricanalizzazione dell’arteria colpevole dell’infarto – questa complicanza è oggi calcolata tra il 5-8 %, e rimane ancora elevata in quei pazienti che giungono in ospedale tardivamente e/o che subiscono una riperfusione coronarica tardiva.
La definizione clinica di shock cardiogeno più uniformemente accettata è la riduzione della gittata cardiaca con evidenza di ipossia tissutale in presenza di un adeguato volume intravascolare. Anche i criteri emodinamici sono importanti nella diagnosi: la ipotensione persistente e la riduzione dell’indice cardiaco in presenza di elevate pressioni di riempimento dei capillari polmonari. Sebbene un infarto miocardico esteso con una significativa disfunzione ventricolare sinistra e/o destra sia il meccanismo fisiopatologico più comune di SC, anche un infarto meno esteso o un infarto senza sopraslivellamento del tratto ST (NSTEMI), può evolvere in SC nei pazienti con una preesistente disfunzione cardiaca. Esistono inoltre altre complicanze meccaniche in corso di infarto miocardico, come la insufficienza mitralica acuta severa, la rottura del setto interventricolare e/o della parete libera del ventricolo sinistro. I fattori che aumentano il rischio di SC nel contesto di un infarto con sopraslivellamento del tratto ST (STEMI) sono l’età avanzata, il sesso femminile, la sede anteriore, l’ipertensione, il diabete mellito tipo 2, e la cardiopatia ischemica cronica determinata da una malattia coronarica multivasale. È fondamentale quindi che il medico identifichi precocemente i pazienti a rischio e riconosca i segni dello shock, attraverso markers clinici e biochimici, tipici della ipoperfusione tissutale anche in presenza di una pressione arteriosa sistolica (PAS) >90 mm Hg.
Molti pazienti in shock possono inoltre sviluppare una insufficienza multiorgano, similmente ad una sindrome da risposta infiammatoria sistemica (SRIS), tipica dei pazienti con shock settico e caratterizzato da un rialzo delle concentrazioni dei marker infiammatori (leucociti, interleukine, proteina C reattiva), e da febbre (spesso presente nei pazienti con infarto miocardio esteso). Lo shock cardiogeno è pertanto un’emergenza medica che richiede una rapida valutazione per individuarne l’eziologia: l’anamnesi ed un attento esame clinico possono individuare precocemente l’eventuale patologia sottostante e consentirne un trattamento etiologico mirato. Fondamentale risulta l’esecuzione immediata di un ECG, dell’emogasanalisi arteriosa con valutazione dei lattati ed un prelievo ematico per l’emocromo, gli elettroliti e la troponina. Dovrebbe essere eseguito un ecocardiogramma transtoracico urgente in maniera tale da quantificare la funzione ventricolare sinistra ed identificare auspicabilmente le cause meccaniche potenzialmente operabili, quali la rottura del muscolo papillare e il difetto del setto interventricolare correlato all’infarto. Il trattamento dello SC è basato sui principi universali di trattamento di ogni paziente ‘collassato’, assistendo nell’ordine le vie aeree, la respirazione e la circolazione, ottenendo un accesso venoso periferico e correggendo ogni bradiaritmia (con atropina e/o pacemaker temporaneo) o tachiaritmia (mediante cardioversione elettrica) che potrebbero contribuire all’ipotensione.
Inserire una linea arteriosa periferica consente il monitoraggio invasivo in tempo reale della PAS e della PAM. Se i segni clinici o il monitoraggio emodinamico indicano uno scarso riempimento ventricolare sinistro vanno infusi boli endovenosi da 100-200ml di liquidi per ottimizzare le pressioni di riempimento ventricolare sinistro. Se invece per il quadro emodinamico occorre scaricare il ventricolo sinistro, si somministrano diuretici in aggiunta ad inotropi, per prevenire ulteriori insulti ipotensivi che potrebbero essere indotti dalla sola terapia diuretica. L’uso degli inotropi in pazienti acutamente ischemici può avere dei potenziali rischi, ma si rendono indispensabili nella stabilizzazione del paziente e consentire, se appropriata, una rivascolarizzazione urgente. Nei centri ospedalieri (Spoke) senza la possibilità di eseguire una angiografia coronarica con immediata rivascolarizzazione, la priorità dovrebbe essere quella di trasferire appena possibile il paziente presso un centro di riferimento (Hub) con Laboratorio di Emodinamica.
Nel caso in cui il paziente venga ritenuto intrasportabile, l’infusione di inotropi, l’utilizzo del contropulsatore aortico (IABP) se disponibile e la ventilazione meccanica potrebbero essere richiesti per ottimizzare la stabilità prima del trasferimento in ambulanza. Nei pazienti con STEMI, se il trasferimento per angiografia e PCI primaria non può essere organizzato urgentemente, dovrebbe essere considerata la trombolisi sistemica. Nella esecuzione di un’angioplastica coronarica primaria in corso di shock cardiogeno, l’incremento dell’età è uno dei sei predittori negativi per la mortalità intraospedaliera, assieme al sesso femminile, alla presenza di insufficienza renale, alla occlusione totale dell’arteria discendente anteriore, al mancato impianto di stents ed infine al non utilizzo degli inibitori glicoproteici IIb/IIIa. In questi scenari di grave instabilità emodinamica possono essere di ausilio i nuovi dispostivi meccanici per la assistenza al circolo in corso di shock cardiaco, di cui il più diffuso è il contropulsatore aortico (IABP) che aumenta il flusso diastolico coronarico e la gittata cardiaca, riducendo le resistenze vascolari e quindi il lavoro miocardico.
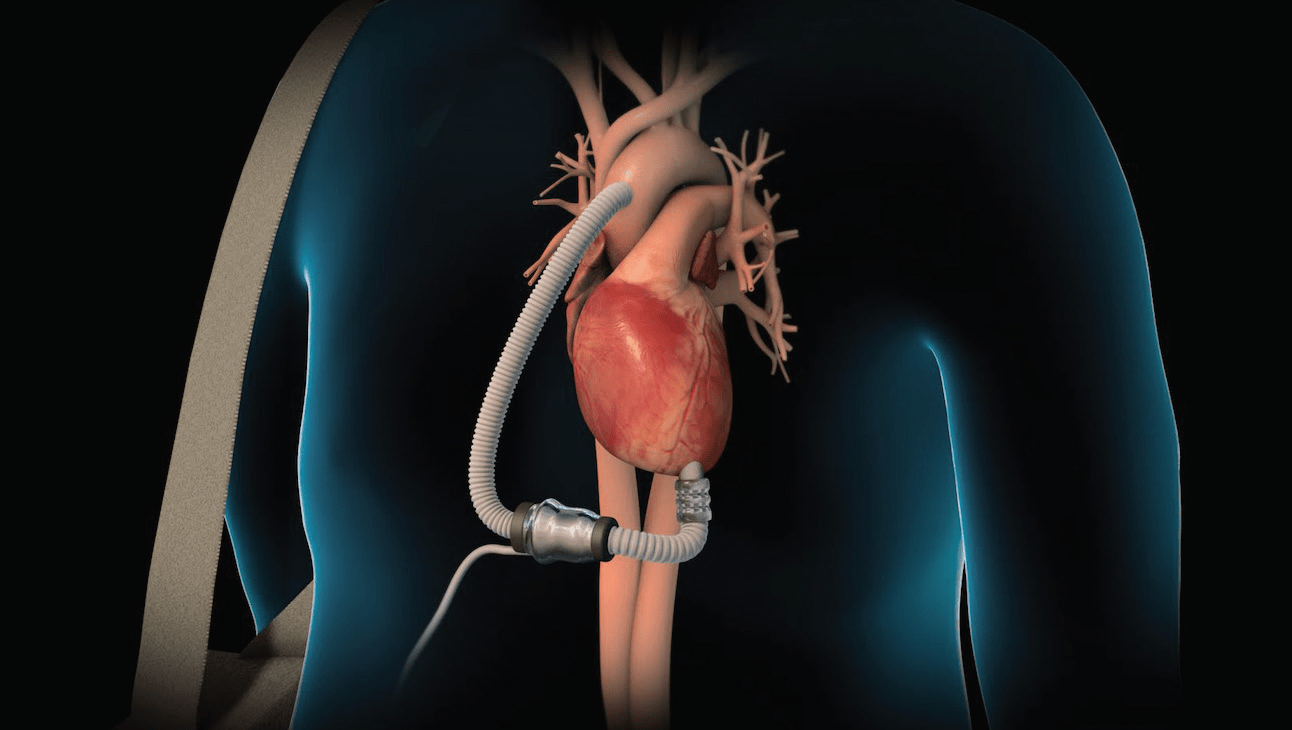 Altro dispositivo elettromeccanico è il dispositivo di assistenza ventricolare (VAD) utile al trattamento dell’insufficienza cardiaca in stadio avanzato. Questi dispositivi impiantabili sono il risultato di oltre 60 anni di ricerca e sono sempre più utilizzati da cardiologi interventisti nei centri di alta specialità. Un presidio di ultima generazione finalizzato al mantenimento in vita del paziente con shock cardiogeno è il supporto vitale extracorporeo (Extracorporeal life support, ECLS) che può vicariare transitoriamente il circolo cardiopolmonare nei pazienti con insufficienza cardiorespiratoria refrattaria, così come l’ECMO (Ossigeno di membrana extracorporeo), entrambi utilizzati come un bypass cardiopolmonare attraverso un sistema meccanico di supporto circolatorio. Tali dispositivi facilmente trasportabili, possono essere utilizzati nel paziente in arresto cardiaco, quale tentativo rianimatorio ed in attesa di una auspicabile e risolutiva procedura di rivascolarizzazione coronarica, come in corso di un infarto miocardico esteso.
Altro dispositivo elettromeccanico è il dispositivo di assistenza ventricolare (VAD) utile al trattamento dell’insufficienza cardiaca in stadio avanzato. Questi dispositivi impiantabili sono il risultato di oltre 60 anni di ricerca e sono sempre più utilizzati da cardiologi interventisti nei centri di alta specialità. Un presidio di ultima generazione finalizzato al mantenimento in vita del paziente con shock cardiogeno è il supporto vitale extracorporeo (Extracorporeal life support, ECLS) che può vicariare transitoriamente il circolo cardiopolmonare nei pazienti con insufficienza cardiorespiratoria refrattaria, così come l’ECMO (Ossigeno di membrana extracorporeo), entrambi utilizzati come un bypass cardiopolmonare attraverso un sistema meccanico di supporto circolatorio. Tali dispositivi facilmente trasportabili, possono essere utilizzati nel paziente in arresto cardiaco, quale tentativo rianimatorio ed in attesa di una auspicabile e risolutiva procedura di rivascolarizzazione coronarica, come in corso di un infarto miocardico esteso.