Lo studio Compass
di Leonardo De Luca
L’Organizzazione Mondiale della Sanità (OMS) ha stimato che nel 2015 la cardiopatia ischemica è stata responsabile di 1 decesso su 7 e stima che nel 2030 essa possa essere causa del 40% dei decessi.
La coronaropatia definita come pregresso infarto o storia di angina con evidenza di coronaropatia multivasale o rivascolarizzazione multivasale, rappresenta ancora oggi una delle più importanti cause di morte a livello globale. Al contempo l’arteriopatia periferica (PAD), di cui si stima siano affetti 200 milioni di individui, risulta essere uno dei più importanti predittori di eventi cerebrovascolari e di mortalità nei pazienti con CAD. Il trial COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies) ha arruolato circa 27.395 pazienti in oltre 600 centri di più di 30 Paesi del mondo e rappresenta oggi una rivoluzione nell’ambito del trattamento antitrombotico dei pazienti con coronaropatia (CAD) cronica e/o arteriopatia periferica (PAD). Al fine di comprendere i risultati ottenuti da questo studio e l’impatto sulla pratica clinica, è fondamentale ricordare come l’approccio sinergico nel trattamento dell’aterosclerosi, sia determinato dalla concomitante inibizione di una via dell’aggregazione piastrinica e della cascata coagulativa. Il razionale di questo approccio deriva proprio dall’osservazione che, elevate concentrazioni di marcatori biochimici correlati all’attivazione della coagulazione (come i prodotti di degradazione della trombina), risultino presenti anche diversi mesi dopo un ricovero per sindrome coronarica acuta (SCA). Pertanto, il rischio residuo dei pazienti con CAD potrebbe in parte essere attribuibile al persistente eccesso di generazione di trombina, considerata come uno dei più potenti attivatori piastrinici.
La terapia standard di doppia anti aggregazione piastrinica (DAPT) contempla sia l’inibizione del TXA2 (aspirina) che dell’ADP (antagonisti del recettore P2Y12). Gli antagonisti del recettore della trombina rappresentano quindi un’alternativa agli attuali trattamenti per la prevenzione degli eventi trombotici avversi. Il rivaroxaban, potente inibitore orale diretto e selettivo del fattore Xa, è già ampiamente utilizzato nella prevenzione del tromboembolismo nell’ambito della fibrillazione atriale (FA) e della tromboembolia venosa (TEV), ma con dosaggi 3 o 4 volte superiori rispetto al cosiddetto dosaggio vascolare (2,5 mg BID), testato in pazienti in ritmo sinusale con aterosclerosi. Il concetto di dosaggio vascolare deriva da due presupposti fisiopatologici e individua, nella terapia dei pazienti con aterosclerosi, una dose di anticoagulante adeguatamente bassa. Sulla scorta di questi presupposti e di studi condotti con warfarin che hanno già individuato i benefici della terapia anticoagulante nella CAD nella prevenzione degli eventi ischemici ricorrenti, seppur a discapito di un incrementato rischio emorragico, quasi tutti gli anticoagulanti orali diretti sono stati valutati nei pazienti con SCA in studi di fase 2 ma solo due, l’apixaban ed i rivaroxaban, sono stati poi testati in ampi studi di fase 3. Sulla base dei risultati ottenuti, è stato successivamente disegnato lo studio ATLAS ACS 2–TIMI 51, che ha valutato i dosaggi di rivaroxaban 2.5 mg BID e 5 mg BID in aggiunta alla terapia antitrombotica standard (DAPT in circa il 95% dei casi) nei pazienti con SCA recente con lo scopo di valutare l’efficacia clinica del dosaggio vascolare In questo trial entrambi i dosaggi di rivaroxaban hanno ridotto il rischio di infarto, ictus o mortalità CV del 16% e trombosi dello stent del 31%. Il dosaggio vascolare di 2.5 mg BID ha inoltre ridotto la mortalità totale.
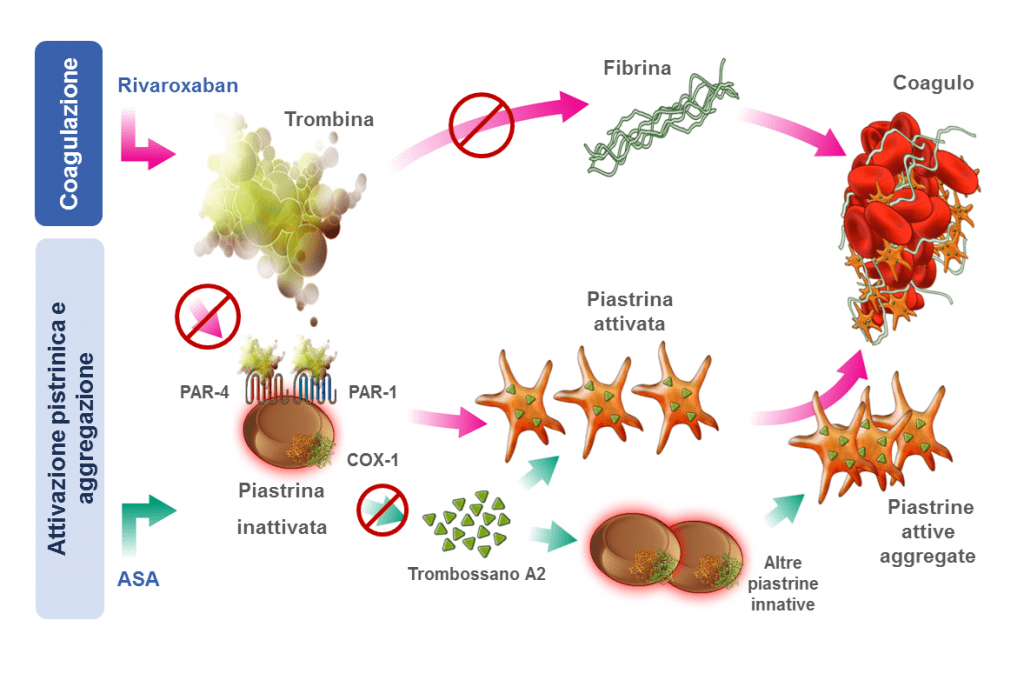
Il COMPASS è un trial di superiorità in doppio cieco, che ha confrontato rivaroxaban (2.5 mg BID) in associazione all’ASA 100 mg/die ed il solo rivaroxaban 5 mg BID vs ASA 100 mg/die per la prevenzione di infarto, ictus, o mortalità CV in pazienti con CAD stabile o PAD. Di questi pazienti, il 90.5% presentava una CAD, ed il 69% di questi una storia di pregresso infarto, per lo più tra 2 e 5 anni. Considerando le singole componenti degli end point primari, si è ottenuta una riduzione del rischio relativo di mortalità CV del 22%, di ictus del 42% ed una riduzione numerica di infarto miocardico a favore del braccio rivaroxaban/ASA vs ASA . La componente dell’endpoint primario che ha quindi pesato maggiormente sul beneficio osservato è quindi ascrivibile all’ictus. Come atteso, i sanguinamenti maggiori sono risultati essere più frequenti nel gruppo rivaroxaban/ASA rispetto alla singola ASA ma senza alcuna differenza nei sanguinamenti fatali, come le emorragie intracraniche o i sanguinamenti sintomatici in organi critici. Nel sottogruppo di pazienti con PAD, la combinazione rivaroxaban/ASA, rispetto all’utilizzo del solo ASA, ha ridotto significativamente l’incidenza dell’endpoint combinato di eventi avversi cardiovascolari e di quelli vascolari periferici, con riduzione significative delle amputazioni di gamba ed il miglioramento della prognosi dopo eventi vascolari periferici. Teoricamente il rivaroxaban a dosaggio vascolare può essere iniziato in qualunque momento nei pazienti eleggibili, benché esistano problematiche e barriere prescrittive.
Ad oggi si può ipotizzare che nei pazienti con PAD (soprattutto nei pazienti con PAD e concomitante CAD ove il beneficio è particolarmente favorevole per l’associazione rivaroxaban/ASA) la prescrizione sia semplice in quanto si può iniziare durante il ricovero o la visita ambulatoriale. Va aggiunto che nell’ambito della PAD, le opzioni farmacologiche per ridurre l’elevata ricorrenza di eventi avversi sono esigue, motivo per il quale nuove ed efficaci terapie sono quanto mai ambite dal clinico. Di contro, nei pazienti con CAD sembra difficile immaginare di aggiungere in regime ambulatoriale un qualsivoglia trattamento antitrombotico in un paziente asintomatico, soprattutto se non ha avuto esperienza di infarto o PCI, in quanto il rischio ischemico residuo percepito sia dal paziente che dal clinico è sottostimato, mentre sovrastimato sembra essere il rischio emorragico associato alla terapia anticoagulante. Appare quindi più verosimile la possibilità di iniziare il rivaroxaban a dosaggio vascolare durante un ricovero ospedaliero in un paziente con CAD cronica, magari già sottoposto a PCI (al di fuori del periodo di DAPT raccomandato) o ricoverato per altre cause CV ma con storia anamnestica di CAD. Nei pazienti con CAD e pregresso infarto la prescrizione sembra ancora più facile nella pratica clinica ma la tempistica di prescrizione appare cruciale. I pazienti con CAD e storia di infarto miocardico vengono per lo più valutati in ambito ospedaliero ad un anno dall’evento indice. Appare quindi ragionevole che sia questo il principale momento di valutazione ove in un prossimo futuro si dovrà identificare il candidato ideale a ricevere qualcosa in più in termini di protezione antitrombotica e decidere quindi se è più opportuno prolungare la DAPT, scelta semplice e ovvia dal punto di vista eminentemente pratico ed alla luce di recenti studi di prevenzione secondaria o iniziare questa strategia innovativa alla luce degli straordinari risultati del COMPASS.







